Grupo Tosyl
A toluenosulfonilo (abreviado tosilo , abreviado Ts [nb 1] o Tos ) grupo , H 3 CC 6 H 4 SO 2 , es un grupo orgánico univalente que consiste en un grupo tolilo , H 3 CC 6 H 4 , unido a un sulfonilo grupo , SO 2 , con valencia abierta sobre azufre. Este grupo generalmente se deriva del compuesto cloruro de tosilo , H 3 CC 6 H 4 SO 2Cl (abreviado TsCl), que forma ésteres y amidas del ácido toluenosulfónico , H 3 CC 6 H 4 SO 2 OH (abreviado TsOH). La orientación para ilustrada ( p -toluenosulfonilo) es la más común y, por convención, tosilo sin prefijo se refiere al grupo p -toluensulfonilo.
El toluenosulfonato (o tosilato ) grupo se refiere a la H
3CC
6H
4ASI QUE
3(TsO) grupo, con un oxígeno adicional unido al azufre y valencia abierta en un oxígeno. [1] En un nombre químico, el término tosilato puede referirse a las sales que contienen el anión del ácido p -toluenosulfónico, TsO - M + (M = metal alcalino, NR 4 , PR 4 , etc.), o puede referirse a ésteres de ácido p -toluenosulfónico, TsOR (R = grupo organilo).
Aplicaciones
Para las reacciones S N 2 , los alcoholes de alquilo también se pueden convertir en tosilatos de alquilo, a menudo mediante la adición de cloruro de tosilo. En esta reacción, el par solitario del oxígeno del alcohol ataca el azufre del cloruro de tosilo, desplazando el cloruro y formando el tosilato con retención de la estereoquímica del reactivo. Esto es útil porque los alcoholes son pobres grupos salientes en las reacciones S N 2, en contraste con el grupo tosilato. Es la transformación de alcoholes alquílicos en tosilatos de alquilo lo que permite que ocurra una reacción S N 2 en presencia de un buen nucleófilo.
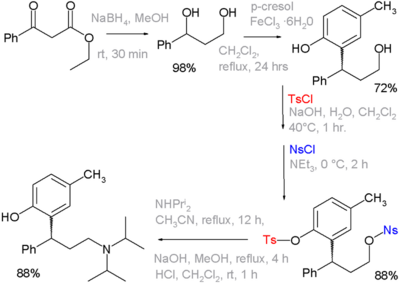
Un grupo tosilo puede funcionar como grupo protector en síntesis orgánica. Los alcoholes se pueden convertir en grupos tosilato para que no reaccionen. Posteriormente, el grupo tosilato puede volver a convertirse en alcohol. El uso de estos grupos funcionales se ejemplifica en la síntesis orgánica del fármaco tolterodina , en la que en una de las etapas se protege un grupo fenol como su tosilato y el alcohol primario como su nosilato. Este último es un grupo saliente para el desplazamiento por diisopropilamina : [2] [nb 2]
El grupo tosilo también es útil como grupo protector de aminas . La estructura de sulfonamida resultante es extremadamente estable. Puede desprotegerse para revelar la amina usando condiciones reductoras o fuertemente ácidas. [3]
Protección de amina - tosyl (Ts)
El grupo tosilo ( Ts ) se usa comúnmente como grupo protector para aminas en síntesis orgánica .
Métodos de protección de aminas más comunes
Métodos de desprotección de aminas más comunes
- HBr y ácido acético a 70 ° C [5]
- Reflujo con TMSCl , yoduro de sodio y acetonitrilo [6]
- Reducción con SmI 2 [7]
- Reducción con Red-Al [8]
Compuestos relacionados
Estrechamente relacionados con los tosilatos están los nosilatos y brosilatos , que son los nombres abreviados de o - o p- nitrobencenosulfonatos y p -bromobencenosulfonatos, respectivamente.
Ver también
- Ácido tosílico
- Grupo sulfonilo
Notas
- ^ No confundir con el elemento sintético tennessine
- ^ Secuencia de reacción: reducción orgánica de benzoilacetato de etilo por borohidruro de sodio a un diol, seguida de alquilación de Friedel-Crafts con p-cresol y cloruro de hierro (III) a un fenol. Los grupos tosilo y nosilo se introducen como sus respectivos cloruros con hidróxido de sodio o trietilamina como base. El siguiente paso es el desplazamiento nucleofílico del grupo nosilo por diisopropilamina , el grupo tosilo restante se elimina mediante otra ronda de NaOH. No mostrado: resolución óptica por ácido L-tartárico al isómero (R) ópticamente puro
Referencias
- ^ Smith, Michael B .; Marzo, Jerry (2007). Química orgánica avanzada de marzo (6ª ed.). John Wiley e hijos. pag. 497. ISBN 978-0-471-72091-1.
- ^ Kathlia A. De Castro; Jungnam Ko; Parque Daejong; Sungdae Park y Hakjune Rhee (2007). "Reducción de benzoilacetato de etilo y protección selectiva de 2- (3-hidroxi-1-fenilpropil) -4-metilfenol: una síntesis nueva y fácil de tolterodina". La investigación y el desarrollo de procesos orgánicos (artículo ASAP) requiere ( ayuda ) . 11 (5): 918. doi : 10.1021 / op7001134 .
|format=|url= - ^ Greene, TW; Wuts, PGM (1999). Grupos protectores en síntesis orgánica . Nueva York: John Wiley & Sons. págs. 603–607. ISBN 9780471160199.
- ^ Wuts, Peter GM; Greene, Theodora W. (2006). Grupos protectores de Greene en síntesis orgánica, cuarta edición - Wuts - Wiley Online Library . doi : 10.1002 / 0470053488 . ISBN 9780470053485.
- ^ Haskell, Betty E .; Bowlus, Stephen B. (1 de enero de 1976). "Nueva síntesis del ácido L-2-amino-3-oxalilaminopropiónico, la neurotoxina de Lathyrus sativus". La Revista de Química Orgánica . 41 (1): 159–160. doi : 10.1021 / jo00863a042 . ISSN 0022-3263 . PMID 1244456 .
- ^ Sabitha, Gowravaram; Reddy, BV Subba; Abraham, Sunny; Yadav, JS (19 de febrero de 1999). "Desprotección de sulfonamidas mediante yodotrimetilsilano". Letras de tetraedro . 40 (8): 1569-1570. doi : 10.1016 / S0040-4039 (98) 02646-X .
- ^ Vedejs, Edwin; Lin, Shouzhong (abril de 1994). "Desprotección de arenosulfonamidas con yoduro de samario" . La Revista de Química Orgánica . 59 (7): 1602–1603. doi : 10.1021 / jo00086a005 . ISSN 0022-3263 .
- ^ Oro, Elijah H .; Babad, Esther. (1 de junio de 1972). "Escisión reductora de sulfonamidas con hidruro de sodio bis (2-metoxietoxi) aluminio" . La Revista de Química Orgánica . 37 (13): 2208-2210. doi : 10.1021 / jo00978a034 . ISSN 0022-3263 .
- Grupos sulfonilo
- Saliendo de grupos
- Ésteres de sulfonato