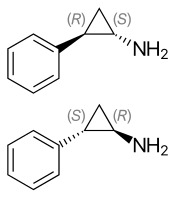
 (1 S , 2 R ) - (-) - tranilcipromina (arriba), (1 R , 2 S ) - (+) - tranilcipromina (abajo) | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Parnate, muchos genéricos [1] |
| Otros nombres | trans -2- fenilcy clo pro pyla mine |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a682088 |
Categoría de embarazo |
|
| Vías de administración | Oral |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 50% [2] |
| Metabolismo | Hígado [3] [4] |
| Vida media de eliminación | 2,5 horas [2] |
| Excreción | Orina , heces [2] |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL |
|
| Tarjeta de información ECHA | 100.005.312 |
| Datos químicos y físicos | |
| Fórmula | C 9 H 11 N |
| Masa molar | 133,194 g · mol −1 |
| Modelo 3D ( JSmol ) |
|
| Quiralidad | Mezcla racémica |
Sonrisas
| |
InChI
| |
| | |
La tranilcipromina (vendida bajo el nombre comercial Parnate entre otros) [1] es un inhibidor de la monoaminooxidasa (IMAO); más específicamente, la tranilcipromina actúa como inhibidor no selectivo e irreversible de la enzima monoamino oxidasa (MAO). [2] [5] Se utiliza como agente antidepresivo y ansiolítico en el tratamiento clínico de los trastornos del estado de ánimo y de ansiedad , respectivamente.
La tranilcipromina es una propilamina formada por la ciclación de la cadena lateral de la anfetamina ; por lo tanto, se clasifica como anfetamina sustituida .
Usos médicos [ editar ]
La tranilcipromina se usa para tratar el trastorno depresivo mayor , incluida la depresión atípica , especialmente cuando hay un componente de ansiedad , generalmente como tratamiento de segunda línea. [6] También se utiliza en la depresión que no responde a los antidepresivos inhibidores de la recaptación , como los ISRS , los ATC o el bupropión . [7]
Contraindicaciones [ editar ]
Las contraindicaciones incluyen: [6] [7] [8]
- Porfiria
- Enfermedad cardiovascular o cerebrovascular
- Feocromocitoma
- La tiramina , que se encuentra en varios alimentos, es metabolizada por MAO. La ingestión y absorción de tiramina provoca una liberación extensa de noradrenalina , que puede aumentar rápidamente la presión arterial hasta el punto de provocar una crisis hipertensiva .
- El uso concomitante de fármacos potenciadores de la serotonina, incluidos los ISRS , los ATC serotoninérgicos , el dextrometorfano y la meperidina, puede causar síndrome serotoninérgico .
- El uso concomitante de ARM , que incluyen fenfluramina , anfetamina y pseudoefedrina, puede causar toxicidad a través del síndrome serotoninérgico o crisis hipertensiva .
- La L -DOPA administrada sin carbidopa puede provocar una crisis hipertensiva.
Restricciones dietéticas [ editar ]
La tiramina es un componente común en muchos alimentos y normalmente la MAO-A la metaboliza rápidamente . Las personas que no toman IMAO pueden consumir al menos 2 gramos de tiramina en una comida y no experimentar un aumento de la presión arterial, mientras que aquellos que toman IMAO como tranilcipromina pueden experimentar un fuerte aumento de la presión arterial después del consumo de tan solo 10 mg de tiramina. que puede conducir a una crisis hipertensiva. [9] [8]
Los alimentos que contienen tiramina incluyen quesos curados , embutidos , queso de soja y ciertos vinos tintos . Algunos, como los extractos de levadura , contienen suficiente tiramina como para ser potencialmente fatales en una sola porción. También es probable que los alimentos en mal estado contengan niveles peligrosos de tiramina. [6]
Efectos adversos [ editar ]
Incidencia de efectos adversos [10]
Los efectos adversos muy frecuentes (> 10% de incidencia) incluyen:
- Mareos secundarios a hipotensión ortostática (17%)
Los efectos adversos comunes (incidencia del 1 al 10%) incluyen:
- Taquicardia (5-10%)
- Hipomanía (7%)
- Parestesia (5%)
- Pérdida de peso (2%)
- Confusión (2%)
- Sequedad de boca (2%)
- Trastornos de la función sexual (2%)
- Hipertensión (1 a 2 horas después de la ingestión) (2%)
- Erupción (2%)
- Retención urinaria (2%)
Otros efectos adversos (incidencia desconocida) incluyen:
- Aumento / disminución del apetito
- Discrasias sanguíneas
- Dolor de pecho
- Diarrea
- Edema
- Alucinaciones
- Hiperreflexia
- Insomnio
- Ictericia
- Calambres en las piernas
- Mialgia
- Palpitaciones
- Sensación de frío
- Ideación suicida
- Temblor
Es de destacar que no se ha encontrado una correlación entre el sexo y la edad menor de 65 años con respecto a la incidencia de efectos adversos. [10]
La tranilcipromina no se asocia con el aumento de peso y tiene un riesgo bajo de hepatotoxicidad en comparación con los IMAO de hidracina . [10] [7]
En general, se recomienda que se suspendan los IMAO antes de la anestesia ; sin embargo, esto crea un riesgo de depresión recurrente. En un estudio de cohorte observacional retrospectivo, los pacientes con tranilcipromina sometidos a anestesia general tuvieron una menor incidencia de hipotensión intraoperatoria, mientras que no hubo diferencia entre los pacientes que no tomaron un IMAO con respecto a la incidencia intraoperatoria de bradicardia , taquicardia o hipertensión. [11] El uso de fármacos simpaticomiméticos indirectos o fármacos que afectan la recaptación de serotonina, como la meperidina o el dextrometorfano, plantea un riesgo de hipertensión y síndrome de serotonina.respectivamente; se recomiendan agentes alternativos. [12] [13] Otros estudios han llegado a conclusiones similares. [10] Las interacciones farmacocinéticas con anestésicos son poco probables, dado que la tranilcipromina es un sustrato de alta afinidad por CYP2A6 y no inhibe las enzimas CYP a concentraciones terapéuticas. [9]
Se ha informado de abuso de tranilcipromina en dosis que oscilan entre 120 y 600 mg por día. [6] [14] [10] Se cree que las dosis más altas tienen más efectos similares a las de las anfetaminas y el abuso es promovido por el inicio rápido y la vida media corta de la tranilcipromina. [10]
Se han notificado casos de ideación suicida y comportamientos suicidas durante el tratamiento con tranilcipromina o poco después de la interrupción del tratamiento. [6]
Los síntomas de la sobredosis de tranilcipromina son generalmente manifestaciones más intensas de sus efectos habituales. [6]
Interacciones [ editar ]
Además de los medicamentos concomitantes contraindicados, la tranilcipromina inhibe el CYP2A6 , lo que puede reducir el metabolismo y aumentar la toxicidad de los sustratos de esta enzima, como: [8]
- Dexmedetomidina
- nicotina
- TSNA (que se encuentran en los productos de tabaco curado, incluidos los cigarrillos )
- Valproato
Los inhibidores de la recaptación de norepinefrina previenen la captación neuronal de tiramina y pueden reducir sus efectos presores . [8]
Farmacología [ editar ]
Farmacodinámica [ editar ]
La tranilcipromina actúa como inhibidor no selectivo e irreversible de la monoaminooxidasa. [2] Con respecto a las isoformas de la monoamino oxidasa, muestra una ligera preferencia por la isoenzima MAOB sobre la MAOA . [9] Esto conduce a un aumento en la disponibilidad de monoaminas , como serotonina , norepinefrina y dopamina , así como a un marcado aumento en la disponibilidad de trazas de aminas , como triptamina , octopamina y fenetilamina . [9] [8] No está clara la relevancia clínica de una mayor disponibilidad de trazas de aminas.
También puede actuar como inhibidor de la recaptación de norepinefrina a dosis terapéuticas más altas. [9] En comparación con la anfetamina , la tranilcipromina muestra una baja potencia como agente liberador de dopamina , con una potencia aún más débil para la liberación de norepinefrina y serotonina . [9] [8]
También se ha demostrado que la tranilcipromina inhibe la histona desmetilasa, BHC110 / LSD1 . La tranilcipromina inhibe esta enzima con una CI50 <2 μM, por lo que actúa como un inhibidor de moléculas pequeñas de la desmetilación de histonas con un efecto de desreprimir la actividad transcripcional de los genes diana BHC110 / LSD1. [15] Se desconoce la relevancia clínica de este efecto.
Se ha descubierto que la tranilcipromina inhibe el CYP46A1 a concentraciones nanomolares. [16] Se desconoce la relevancia clínica de este efecto.
Farmacocinética [ editar ]
Tranilcipromina alcanza su concentración máxima (t max ) dentro de 1-2 horas. [9] Después de una dosis de 20 mg, las concentraciones plasmáticas alcanzan un máximo de 50 a 200 ng / ml. [9] Si bien su vida media es de solo 2 horas, sus efectos farmacodinámicos duran de varios días a semanas debido a la inhibición irreversible de la MAO. [9]
Los metabolitos de la tranilcipromina incluyen 4-hidroxitranilcipromina, N- acetiltranilcipromina y N -acetil-4-hidroxitranilcipromina, que son inhibidores de la MAO menos potentes que la tranilcipromina en sí. [9] Alguna vez se pensó que la anfetamina era un metabolito de la tranilcipromina, pero no se ha demostrado que lo sea. [9] [18] [8]
La tranilcipromina inhibe el CYP2A6 a concentraciones terapéuticas. [8]
Química [ editar ]
Síntesis [ editar ]
Historia [ editar ]
La tranilcipromina se desarrolló originalmente como un análogo de la anfetamina . [2] [9] Aunque se sintetizó por primera vez en 1948, [20] su acción IMAO no se descubrió hasta 1959. Precisamente porque la tranilcipromina no era, como la isoniazida y la iproniazida , un derivado de la hidracina , su interés clínico aumentó enormemente, ya que se pensó que podría tener un índice terapéutico más aceptable que los IMAO anteriores. [21]
El fármaco fue introducido por Smith, Kline y French en el Reino Unido en 1960 y aprobado en los Estados Unidos en 1961. [22] Se retiró del mercado en febrero de 1964 debido a una serie de muertes de pacientes que involucraron crisis hipertensivas con problemas intracraneales. sangrado. Sin embargo, se reintrodujo más tarde ese año con indicaciones más limitadas y advertencias específicas de los riesgos. [23] [9] [8]
Investigación [ editar ]
Se sabe que la tranilcipromina inhibe la LSD1 , una enzima que desmetila selectivamente dos lisinas que se encuentran en la histona H3 . [15] [9] [24] Los genes promovidos aguas abajo de LSD1 están involucrados en el crecimiento y la metástasis de las células cancerosas, y varias células tumorales expresan altos niveles de LSD1. [24] Se están investigando análogos de tranilcipromina con actividad inhibidora de LSD1 más potente y selectiva en el tratamiento potencial de cánceres. [24] [25]
La tranilcipromina puede tener propiedades neuroprotectoras aplicables al tratamiento de la enfermedad de Parkinson , similares a los inhibidores de la MAO-B selegilina y rasagilina . [26] [7] A partir de 2017, solo se realizó un ensayo clínico en pacientes con Parkinson, que encontró alguna mejoría inicialmente y solo un ligero empeoramiento de los síntomas después de un seguimiento de 1,5 años. [7]
Ver también [ editar ]
- Fenelzina
- Anfetamina
- Cibenzolina (también a base de ciclopropano)
- Ticagrelor (contiene motivo estructural 3 ', 4'-difluoro-tranilcipromina )
- Tranilcipromina / trifluoperazina
Referencias [ editar ]
- ^ a b Drugs.com Marcas internacionales de Tranylcypromine . Página consultada el 17 de abril de 2016
- ↑ a b c d e f Williams DA (2007). "Antidepresivos" . En Foye, William O., Lemke, Thomas L., Williams, David A. (eds.). Principios de química medicinal de Foye . Hagerstwon, Estados Unidos: Lippincott Williams & Wilkins. págs. 590–1. ISBN 978-0-7817-6879-5.
- ^ "Tranilcipromina" . www.drugbank.ca . Consultado el 6 de diciembre de 2019 .
- ^ Baker GB, Urichuk LJ, McKenna KF, Kennedy SH (junio de 1999). "Metabolismo de los inhibidores de la monoaminooxidasa". Neurobiología celular y molecular . 19 (3): 411-26. doi : 10.1023 / a: 1006901900106 . PMID 10319194 . S2CID 21380176 .
- ^ Baldessarini RJ (2005). "17. Tratamiento farmacológico de la depresión y los trastornos de ansiedad". En Brunton LL, Lazo JS, Parker KL (eds.). Goodman & Gilman, The Pharmacological Basis of Therapeutics . Nueva York: McGraw-Hill. ISBN 978-0-07-142280-2.
- ^ a b c d e f Compendio de medicamentos electrónicos del Reino Unido. Tranylcypromine Llast actualizado el 28 de octubre de 2015
- ↑ a b c d e Riederer P, Laux G (marzo de 2011). "Inhibidores de la MAO en la enfermedad de Parkinson" . Neurobiología experimental . 20 (1): 1-17. doi : 10.5607 / en.2011.20.1.1 . PMC 3213739 . PMID 22110357 .
- ^ a b c d e f g h i Gillman PK (febrero de 2011). "Avances relacionados con la farmacología y las interacciones de los inhibidores de la monoaminooxidasa no selectivos irreversibles". Revista de psicofarmacología clínica . 31 (1): 66–74. doi : 10.1097 / JCP.0b013e31820469ea . PMID 21192146 . S2CID 10525989 .
- ^ a b c d e f g h i j k l m n Ulrich S, Ricken R, Adli M (agosto de 2017). "Tranilcipromina en mente (parte I): revisión de farmacología" . Neuropsicofarmacología europea . 27 (8): 697–713. doi : 10.1016 / j.euroneuro.2017.05.007 . PMID 28655495 . S2CID 4913721 .
- ↑ a b c d e f Ricken R, Ulrich S, Schlattmann P, Adli M (agosto de 2017). "Tranilcipromina en mente (parte II): revisión de farmacología clínica y metanálisis de estudios controlados en depresión" . Neuropsicofarmacología europea . 27 (8): 714–731. doi : 10.1016 / j.euroneuro.2017.04.003 . PMID 28579071 . S2CID 30987747 .
- ^ van Haelst IM, van Klei WA, Doodeman HJ, Kalkman CJ, Egberts TC (agosto de 2012). "Tratamiento antidepresivo con inhibidores de la monoaminooxidasa y ocurrencia de eventos hemodinámicos intraoperatorios: un estudio de cohorte observacional retrospectivo". La Revista de Psiquiatría Clínica . 73 (8): 1103–9. doi : 10.4088 / JCP.11m07607 . PMID 22938842 .
- ^ Smith MS, Muir H, Hall R (febrero de 1996). "Manejo perioperatorio de la farmacoterapia, consideraciones clínicas". Drogas . 51 (2): 238–59. doi : 10.2165 / 00003495-199651020-00005 . PMID 8808166 . S2CID 46972638 .
- ^ Blom-Peters L, Lamy M (1993). "Anestesia y inhibidores de la monoaminooxidasa: una revisión de la literatura actualizada". Acta Anaesthesiologica Belgica . 44 (2): 57–60. PMID 8237297 .
- ^ Le Gassicke J, Ashcroft GW, Eccleston D, Evans JI, Oswald I, Ritson EB (1 de abril de 1965). "El estado clínico, el sueño y el metabolismo de la amina de un adicto a la tranilcipromina ('Parnate')". The British Journal of Psychiatry . 111 (473): 357–364. doi : 10.1192 / bjp.111.473.357 .
- ↑ a b Lee MG, Wynder C, Schmidt DM, McCafferty DG, Shiekhattar R (junio de 2006). "La desmetilación de la lisina 4 de la histona H3 es un objetivo de los medicamentos antidepresivos no selectivos" . Química y Biología . 13 (6): 563–7. doi : 10.1016 / j.chembiol.2006.05.004 . PMID 16793513 .
- ^ Mast N, Charvet C, Pikuleva IA, Stout CD (octubre de 2010). "Base estructural de la unión del fármaco a CYP46A1, una enzima que controla el recambio de colesterol en el cerebro" . La Revista de Química Biológica . 285 (41): 31783–95. doi : 10.1074 / jbc.M110.143313 . PMC 2951250 . PMID 20667828 .
- ^ Gaweska H, Fitzpatrick PF (octubre de 2011). "Estructuras y mecanismo de la familia de monoamino oxidasa" . Conceptos biomoleculares . 2 (5): 365–377. doi : 10.1515 / BMC.2011.030 . PMC 3197729 . PMID 22022344 .
- ^ Sherry RL, Rauw G, McKenna KF, Paetsch PR, Coutts RT, Baker GB (diciembre de 2000). "No detectar anfetamina o 1-amino-3-fenilpropano en humanos o ratas que reciben el inhibidor de MAO tranilcipromina". Revista de trastornos afectivos . 61 (1–2): 23–9. doi : 10.1016 / s0165-0327 (99) 00188-3 . PMID 11099737 .
- ^ Una patente estadounidense 4016204 A , Vithal Jagannath Rajadhyaksha, "Método de síntesis de trans-2-fenilciclopropilamina", publicada el 05 de abril de 1977, asignada a Nelson Research & Development Company
- ^ Hamburguesa A, Yost WL (1948). "Arilcicloalquilaminas. I. 2-Fenilciclopropilamina". Revista de la Sociedad Química Estadounidense . 70 (6): 2198–2201. doi : 10.1021 / ja01186a062 .
- ^ López-Muñoz F, Alamo C (2009). "Neurotransmisión monoaminérgica: la historia del descubrimiento de los antidepresivos desde la década de 1950 hasta la actualidad". Diseño Farmacéutico Actual . 15 (14): 1563–86. doi : 10.2174 / 138161209788168001 . PMID 19442174 .
- ↑ Shorter E (2009). Antes del Prozac: la problemática historia de los trastornos del estado de ánimo en psiquiatría . Oxford [Oxfordshire]: Oxford University Press. ISBN 978-0-19-536874-1.
- ^ Atchley DW (septiembre de 1964). "Reevaluación del sulfato de tranilcipromina (sulfato de parnato)". JAMA . 189 (10): 763–4. doi : 10.1001 / jama.1964.03070100057011 . PMID 14174054 .
- ^ a b c Zheng YC, Yu B, Jiang GZ, Feng XJ, He PX, Chu XY, et al. (2016). "Inhibidores irreversibles de LSD1: aplicación de tranilcipromina y sus derivados en el tratamiento del cáncer". Temas actuales en química medicinal . 16 (19): 2179–88. doi : 10.2174 / 1568026616666160216154042 . PMID 26881714 .
- ^ Przespolewski A, Wang ES (julio de 2016). "Inhibidores de LSD1 como terapia potencial para la leucemia mieloide aguda". Opinión de expertos sobre fármacos en investigación . 25 (7): 771–80. doi : 10.1080 / 13543784.2016.1175432 . PMID 27077938 . S2CID 20858344 .
- ^ Al-Nuaimi SK, Mackenzie EM, Baker GB (noviembre de 2012). "Inhibidores de la monoaminooxidasa y neuroprotección: una revisión". Revista estadounidense de terapéutica . 19 (6): 436–48. doi : 10.1097 / MJT.0b013e31825b9eb5 . PMID 22960850 .