 | |
 | |
| Datos clinicos | |
|---|---|
| Vías de administración | Oral , vaporizado , insuflado , inyectado |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 62% oral; 79% nasal; 91 - 93,5% ahumado; 100% IV |
| Metabolismo | Hepático |
| Vida media de eliminación | 10-19 horas |
| Excreción | Renal |
| Identificadores | |
| |
| Número CAS |
|
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII |
|
| Datos químicos y físicos | |
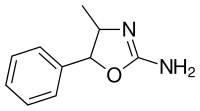
| Fórmula | C 10 H 12 N 2 O |
| Masa molar | 176,21 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| Quiralidad | Mezcla racémica |
| |
| |
| | |
El 4-metilaminorex ( 4-MAR , 4-MAX ) es un fármaco estimulante de la clase 2- amino- 5- ariloxazolina que fue sintetizado por primera vez en 1960 por McNeil Laboratories. [1] También es conocido por sus nombres de calles " U4Euh " (" Euphoria ") y " Ice ". Está prohibido en muchos países como estimulante .
El 4-metilaminorex tiene efectos comparables a los de la metanfetamina pero de mayor duración.
Los resultados de experimentos con animales realizados con esta droga sugieren que tiene un riesgo de abuso similar al de la cocaína y la anfetamina. Un estudio encontró que, "las propiedades de estímulo de cis racémico, trans racémico y los cuatro isómeros ópticos individuales de 4-metilaminorex se examinaron en ratas entrenadas para discriminar 1 mg / kg de sulfato de anfetamina S (+) de la solución salina. ) estímulo anfetamínico generalizado a todos los agentes investigados ". [2] Un segundo estudio en el que ratas entrenadas para discriminar entre 0,75 mg / kg de S (+) - anfetamina o 1,5 mg / kg de fenfluramina de solución salina generalizada a aminorex como estímulo de anfetamina pero no a fenfluramina. [3]Ratas entrenadas para discriminar 8 mg / kg de cocaína del 4-metilaminorex generalizado salino al estímulo de la cocaína. [4] Los efectos reforzantes del cis-4-metilaminorex se determinaron en dos modelos de autoadministración de fármacos intravenosos en primates. Las dosis de vehículo o 4-metilaminorex se sustituyeron por cocaína. Una de las dos dosis diferentes de 4-metilaminorex mantuvo el comportamiento de autoadministración por encima de los niveles de control del vehículo. [5]
Química [ editar ]
El 4-metilaminorex existe como cuatro estereoisómeros : (±) - cis y (±) - trans . Los isómeros (±) - cis son la forma que se usa de forma recreativa . Los isómeros (±) - cis [racemato (mezcla 1: 1) del isómero (4 R , 5 S ) y el isómero (4 S , 5 R ) enantiomérico] generalmente sintetizados a partir de dl-fenilpropanolamina en un paso por Ciclación con bromuro de cianógeno (a veces preparado in situ haciendo reaccionar cianuro de sodio con bromo). Las rutas de síntesis alternativas generalmente implican más pasos, como reemplazar el bromuro de cianógeno con cianato de sodio o potasio para formar un intermedio y luego hacerlo reaccionar con ácido clorhídrico concentrado . Un método informado en microgramos reemplazó la necesidad de una adición separada de ácido clorhídrico comenzando con la sal de clorhidrato de la dl-fenilpropanolamina, pero se observan productos secundarios. Los isómeros (±) - trans [racemato (mezcla 1: 1) del isómero (4 S , 5 S ) y el isómero (4 R , 5 R ) enantiomérico] se sintetizan de la misma manera anterior pero dl- norefedrinaen su lugar se utiliza como material de partida. La reacción de cianato procede de manera diferente a la del bromuro de cianógeno y en su lugar transforma la norefedrina en trans-4-metilaminorex, como se indica en la micrografía de la DEA. El bromuro de cianógeno, en comparación, transformó la norefedrina en el isómero cis y la norpseudoefedrina en los isómeros trans del producto final.
Dosis [ editar ]
El 4-metilaminorex se puede fumar, insuflar o tomar por vía oral.
Como anoréxico , la DE50 es de 8,8 mg / kg en ratas para los isómeros (±) - cis . Los isómeros (±) - trans son ligeramente más potentes a 7,0 mg / kg. Como droga recreativa , la dosis efectiva varía de 5 a 25 mg. [6]
En la década de 1970, McNeil Laboratories , Inc. estaba tratando de llevar el 4-metilaminorex al mercado de medicamentos como simpaticomimético (más comúnmente utilizado como medicamentos para el asma), el nombre de la investigación era McN-822, mencionaron que la dosis humana habría sido de 0.25 mg / kg de peso corporal. También mencionan DL50: 17 mg / kg po para ratones [7]
Existe una patente sobre el uso de 4-metilaminorex "como descongestionante nasal que, cuando se administra por vía oral, no produce efectos estimulantes adversos del sistema nervioso central como se experimenta con otros descongestionantes y anorexiantes". La dosis mencionada es de 0,25 mg / kg de peso corporal. [8]
Efectos [ editar ]
Produce efectos de larga duración, generalmente hasta 16 horas de duración si se toma por vía oral y hasta 12 horas si se fuma o se insufla . Se ha informado anecdóticamente que grandes dosis duran hasta 36 horas. Los efectos son de naturaleza estimulante , producen euforia , mayor atención y mayor cognición . De manera anecdótica, se ha informado que produce efectos similares a los nootrópicos . Sin embargo, no existe ninguna investigación que apoye la afirmación de que es diferente o más eficaz que otros psicoestimulantes a este respecto. Además, el 4-metilaminorex no tiene el perfil de seguridad establecido de los psicoestimulantes clínicos ampliamente utilizados, como el metilfenidato y la dextroanfetamina..
| Tiempo (h) | Concentración de 4-metilaminorex en orina (µg / ml) |
|---|---|
| 0-6 | 45 |
| 6-24 | 1.0 |
| 24-36 | 0,1 |
| 36-48 | no detectado |
Se ha informado de una muerte debido al 4-metilaminorex y al diazepam. Las concentraciones de 4-metilaminorex fueron: en sangre 21,3 mg / L; en orina 12,3 mg / L. La concentración de diazepam en sangre fue de 0,8 mg / L. [9] Un experimento en ratas ha estudiado la excreción de 4-metilaminorex en la orina: "La concentración de trans-4-metilaminorex en la orina de rata después de cuatro inyecciones del isómero trans-4S, 5S 5 mg / kg ip cada una, a intervalos de 12 h en 2 días, medido cuantitativamente por GC / MS ". [10]
Otro estudio se centró en la farmacocinética y la distribución tisular de los estereoisómeros del 4-metilaminorex en ratas. [11]
"La hipertensión pulmonar se ha asociado con la ingestión del supresor del apetito aminorex. Se descubrió un compuesto similar, 4-metilaminorex, en la propiedad de tres individuos con diagnóstico de hipertensión pulmonar". [12]
Estudios de neurotoxicidad [ editar ]
Se han realizado tres estudios que estudian la posible neurotoxicidad del 4-metilaminorex. Primer estudio [13] que utilizó dosis bastante altas (la dosis más alta causó convulsiones clónicas y algunas ratas murieron) en ratas y estudió los efectos a corto plazo (las ratas se sacrificaron de 30 min a 18 h después de la inyección de 5, 10 o 20 mg / kg de racémico cis-4-metilaminorex) sugirió una reducción en la actividad de la triptófano hidroxilasa (TPH) (un posible marcador de la neurotoxicidad de la serotonina), pero citando el estudio: "No se observaron cambios en la actividad de la TPH 30 min después de la inyección; a las 8 h la actividad de esta enzima parecía estar recuperándose ". y "este agente es significativamente menos neurotóxico que la metanfetamina o la MDMA ".
Un estudio [14] publicado 2 años después del primero también sugirió una reducción en la actividad de la triptófano hidroxilasa, también usaron dosis bastante altas (10 mg / kg de cis-4-metilaminorex) y también estudiaron los efectos a largo plazo (las ratas murieron 3 h, 18 ho 7 días después de la inyección), encontraron una reducción del 20-40% de la actividad de la triptófano hidroxilasa (TPH) y "la recuperación de la actividad de TPH ocurrió 18 h después del tratamiento, pero disminuyó significativamente nuevamente a los 7 días". pero "Es digno de mención que, a diferencia de los otros análogos, los niveles estriatales de 5-HT no disminuyeron con la actividad de TPH luego de múltiples tratamientos con 4-metilaminorex".
El último estudio [15] (con ratones) no pudo encontrar ningún efecto a largo plazo que sugiriera neurotoxicidad y, en cambio, encontró un aumento en los niveles de serotonina, también usaron dosis altas (15 mg / kg de cada isómero estudiado) "Las dosis utilizadas en los presentes experimentos son aproximadamente 6-10 veces mayores que las dosis efectivas de inhibición de aminorex y estereoisómeros de la ingesta de alimentos ". Las dosis se repitieron 3 veces al día y los ratones se sacrificaron 7 días después de la última dosis. "Dado que un agotamiento prolongado de la dopamina o 5-HT parece ser un buen predictor de la neurotoxicidad de la dopamina o 5-HT (Wagner et al. 1980; Ricaurte et al. 1985), los resultados sugieren que los compuestos aminorex, excepto 4S, 5S-dimetilaminorex , a diferencia de MDMA ofenfluramina , no son tóxicas ni para la dopamina ni para los sistemas de neurotransmisores 5-HT en ratones CBA . Se informó que aunque múltiples dosis de 4-metilaminorex causaron disminuciones a largo plazo (7 días) en la actividad de la triptófano hidroxilasa estriatal en ratas SD, no se encontraron cambios en los niveles de 5-HT y 5-HIAA (Hanson et al. 1992). [12]
Ese primer estudio [11] también sugirió niveles reducidos de dopamina (DA) (un posible marcador de neurotoxicidad de la dopamina), pero citando el estudio: "Sin embargo, 8 h después de la administración del fármaco no se observaron diferencias con los valores de control en los niveles de DA , DOPAC o HVA . " y nuevamente estudios posteriores [12-13] no encontraron ninguna reducción a largo plazo.
Situación legal [ editar ]
Australia [ editar ]
En Australia , el 4-metilaminorex figura en la Lista 9, lo que lo hace legal solo para la investigación científica y médica. [dieciséis]
Canadá [ editar ]
En Canadá , el 4-metilaminorex figura en la Lista III. [17]
Holanda [ editar ]
En los Países Bajos , el aminorex (4-metilaminorex es una droga de diseño de 2014) es una droga de la Lista I de la Ley del Opio . [18] No está aprobado por el CBG, por lo que se considera que no tiene ningún uso médico.
Reino Unido [ editar ]
En el Reino Unido, el 4-metilaminorex figura como Clase A. [19]
Estados Unidos [ editar ]
En los Estados Unidos , (±) - cis -4-metilaminorex se incluyó en el Anexo I de la Ley de Sustancias Controladas poco después de su aparición como droga recreativa a mediados de la década de 1980. [20] La fabricación del isómero trans requirió un proceso diferente a los encontrados cuando se programó la sustancia por primera vez, y se creía que era menos potente que el isómero cis con un potencial de abuso mucho menor. Sin embargo, estudios que revelan el potencial de abuso del isómero 'trans', [ cita requerida ] junto con el desarrollo de nuevos métodos sintéticos clandestinos que producirían la trans [ cita requerida ]creó una laguna potencial en la ley, que cubría solo el isómero 'cis'. Para aclarar la situación, la Administración de Control de Drogas de EE. UU . Publicó un artículo en su DEA Microgram Journal , con respecto a la interpretación de la ley estatutaria relevante en lo que respecta al estado del trans -4-metilaminorex. En resumen, de acuerdo con esta decisión no vinculante legalmente, el trans -4-metilaminorex no es actualmente una sustancia controlada, sino un posible análogo. De hecho, el informe declara explícitamente:
La [Drug Enforcement Administration] de Estados Unidos tiene la siguiente opinión sobre la legalidad del isómero posicional "trans" -4-metilaminorex, que, a diferencia de su isómero "cis", nunca se incluyó en ninguna lista de la Ley de Sustancias Controladas .
Sin embargo, la opinión dice que la agencia considera que la sustancia es un posible análogo de sustancia controlada , lo que hace que la sustancia sea idéntica a una sustancia de la Lista I si está destinada al consumo humano, de acuerdo con la Ley Federal de Análogos . El informe da cuenta de una condena exitosa en virtud de la Ley Federal de Análogos de un delito que involucra el isómero trans . [21]
Florida [ editar ]
"2-Amino-4-metil-5-fenil-2-oxazolina (4-metilaminorex)" y "cualquier material, compuesto, mezcla o preparación que contenga cualquier cantidad de" eso "o que contenga cualquiera de [sus] sales , isómeros, incluidos isómeros ópticos, posicionales o geométricos, y sales de isómeros, si es posible la existencia de tales sales, isómeros y sales de isómeros "es una sustancia controlada de la Lista I en el estado de Florida que hace que sea ilegal comprar, vender o poseer en Florida. [22]
Ver también [ editar ]
- Lista de análogos de aminorex
- 4,4'-dimetilaminorex
- Aminorex
- Clominorex
- Ciclazodona
- Fenozolona
- Fluminorex
- Pemolina
- Tozalinona
Referencias [ editar ]
- ^ US 3278382 , " Composiciones de 2-amino-5-ariloxazolina y métodos de uso de las mismas"
- ^ Glennon RA, Misenheimer B (marzo de 1990). "Propiedades de estímulo de un nuevo fármaco de diseño: 4-metilaminorex (" U4Euh ")". Farmacología, bioquímica y comportamiento . 35 (3): 517–21. doi : 10.1016 / 0091-3057 (90) 90282-M . PMID 1971111 . S2CID 10464868 .
- ^ Young R (mayo de 1992). "Aminorex produce efectos de estímulo similares a la anfetamina y a diferencia de los de la fenfluramina". Farmacología, bioquímica y comportamiento . 42 (1): 175–8. doi : 10.1016 / 0091-3057 (92) 90462-O . PMID 1356272 . S2CID 31002190 .
- ^ Young R, Glennon RA (mayo de 1993). "Generalización del estímulo de la cocaína a dos nuevas drogas de diseño: metcatinona y 4-metilaminorex". Farmacología, bioquímica y comportamiento . 45 (1): 229–31. doi : 10.1016 / 0091-3057 (93) 90110-F . PMID 8516363 . S2CID 7648152 .
- ^ Mansbach RS, Sannerud CA, Griffiths RR, Balster RL, Harris LS (octubre de 1990). "Autoadministración intravenosa de 4-metilaminorex en primates". Dependencia de drogas y alcohol . 26 (2): 137–44. doi : 10.1016 / 0376-8716 (90) 90120-4 . PMID 2242714 .
- ^ "Bóveda de 4-metilaminorex de Erowid: dosis" .
- ^ "Sistema agotado (catálogo en línea de la Biblioteca del Congreso)" .
- ^ "Método de descongestión de la nariz ... - Patentes de Google" .
- ^ Davis FT, Brewster ME (marzo de 1988). "Una fatalidad que involucra a U4Euh, un derivado cíclico de la fenilpropanolamina". Revista de Ciencias Forenses . 33 (2): 549–53. doi : 10.1520 / JFS11971J . PMID 3373171 .
- ^ Kankaanpää A, Meririnne E, Ellermaa S, Ariniemi K, Seppälä T (septiembre de 2001). "Detección y ensayo de isómeros cis y trans del 4-metilaminorex en muestras de orina, plasma y tejidos". Internacional de Ciencias Forenses . 121 (1–2): 57–64. doi : 10.1016 / S0379-0738 (01) 00453-4 . PMID 11516888 .
- ^ Meririnne E, Ellermaa S, Kankaanpää A, Bardy A, Seppälä T (junio de 2004). "Farmacocinética y distribución tisular de los estereoisómeros del 4-metilaminorex en la rata". La Revista de Farmacología y Terapéutica Experimental . 309 (3): 1198–205. doi : 10.1124 / jpet.103.060053 . PMID 14742748 . S2CID 28124406 .
- ^ a b Gaine SP, Rubin LJ, Kmetzo JJ, Palevsky HI, Traill TA (noviembre de 2000). "Uso recreativo de aminorex e hipertensión pulmonar" . Pecho . 118 (5): 1496–7. doi : 10.1378 / cofre.118.5.1496 . PMID 11083709 . Archivado desde el original el 12 de enero de 2013.
- ^ Bunker CF, Johnson M, Gibb JW, Bush LG, Hanson GR (mayo de 1990). "Efectos neuroquímicos de un tratamiento agudo con 4-metilaminorex: un nuevo estimulante del abuso". Revista europea de farmacología . 180 (1): 103-11. doi : 10.1016 / 0014-2999 (90) 90597-Y . PMID 1973111 .
- ^ Hanson GR, Bunker CF, Johnson M, Bush L, Gibb JW (agosto de 1992). "Respuesta de los sistemas monoaminérgicos y neuropéptidos al 4-metilaminorex: un nuevo estimulante del abuso". Revista europea de farmacología . 218 (2–3): 287–93. doi : 10.1016 / 0014-2999 (92) 90181-3 . PMID 1358636 .
- ^ Zheng Y, Russell B, Schmierer D, Laverty R (enero de 1997). "Los efectos del aminorex y compuestos relacionados en monoaminas cerebrales y metabolitos en ratones CBA". La Revista de Farmacia y Farmacología . 49 (1): 89–96. doi : 10.1111 / j.2042-7158.1997.tb06758.x . PMID 9120777 . S2CID 20224300 .
- ^ "Estándar de venenos 2009" . Consultado el 2 de septiembre de 2009 .
- ^ "Ley de sustancias y drogas controladas" . Consultado el 2 de septiembre de 2009 .
- ^ "Bijlage 1 Lijst I Opiumwetmiddelen" . Archivado desde el original el 25 de junio de 2009 . Consultado el 2 de septiembre de 2009 .
- ^ "LISTA DE DROGAS ACTUALMENTE CONTROLADAS BAJO LA CLASE A" (PDF) . Consultado el 2 de septiembre de 2009 .
- ^ "Sección 1308.11 Anexo I" . Archivado desde el original el 27 de agosto de 2009 . Consultado el 2 de septiembre de 2009 .
- ^ Síntesis de trans-4-metilaminorex de norefedrina y cianato de potasio (DEA Microgram Journal) Archivado 2007-09-30 en Wayback Machine
- ^ Estatutos de Florida - Capítulo 893 - PREVENCIÓN Y CONTROL DEL ABUSO DE DROGAS
Enlaces externos [ editar ]
- Bóveda de 4-metilaminorex de Erowid