grupo bencilo
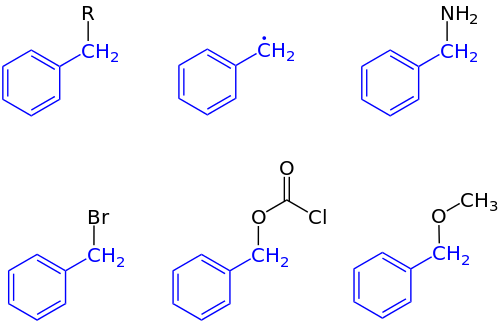
En química orgánica , el bencilo es el sustituyente o fragmento molecular que posee la estructura C 6 H 5 CH 2 –. El bencilo presenta un anillo de benceno unido a un grupo CH 2 . [1]
En la nomenclatura de la IUPAC, el prefijo bencilo se refiere a un sustituyente C 6 H 5 CH 2 , por ejemplo, cloruro de bencilo o benzoato de bencilo . El bencilo no debe confundirse con el fenilo de fórmula C 6 H 5 . El término bencílico se usa para describir la posición del primer carbono unido a un benceno u otro anillo aromático . Por ejemplo, (C 6 H 5 )(CH 3 ) 2 C + se denomina carbocatión "bencílico". El radical libre bencilotiene la fórmula C
6H
5CH•
2. El catión bencilo o ion fenilcarbenio es el carbocatión de fórmula C
6H
5CH+
2; el anión bencilo o ion fenilmetánido es el carbanión con la fórmula C
6H
5CH−
2. Ninguna de estas especies se puede formar en cantidades significativas en la fase de solución en condiciones normales, pero son referentes útiles para la discusión de los mecanismos de reacción y pueden existir como intermedios reactivos.
La abreviatura "Bn" denota bencilo. Por ejemplo, el alcohol bencílico se puede representar como BnOH. Esta abreviatura no debe confundirse con "Bz", que es la abreviatura del grupo benzoílo C 6 H 5 C(O)-, o del grupo fenilo C 6 H 5 , abreviado como "Ph". De manera confusa, en la literatura antigua, "Bz" también se usaba para bencilo.
La reactividad mejorada de las posiciones bencílicas se atribuye a la baja energía de disociación de los enlaces C-H bencílicos. Específicamente, el enlace C 6 H 5 CH 2 −H es entre un 10 y un 15 % más débil que otros tipos de enlaces C−H. El anillo aromático vecino estabiliza los radicales bencilo. Los datos tabulados a continuación comparan el enlace C-H bencílico con las fuerzas de enlace C-H relacionadas.
La debilidad del enlace C−H refleja la estabilidad del radical bencílico. Por razones relacionadas, los sustituyentes bencílicos muestran una mayor reactividad, como en la oxidación , la halogenación por radicales libres o la hidrogenólisis . Como ejemplo práctico, en presencia de catalizadores adecuados, el p - xileno se oxida exclusivamente en las posiciones bencílicas para dar ácido tereftálico :
En unos pocos casos, estas transformaciones bencílicas ocurren en condiciones adecuadas para la síntesis de laboratorio. La reacción de Wohl-Ziegler bromará un enlace C–H bencílico: (ArCHR 2 → ArCBrR 2 ). [5] Cualquier grupo alquilo bencílico no terciario se oxidará a un grupo carboxilo mediante permanganato de potasio acuoso (KMnO 4 ) o ácido nítrico concentrado (HNO 3 ): (ArCHR 2 → ArCOOH). [6] Finalmente, el complejo de trióxido de cromo y 3,5-dimetilpirazol (CrO 3 -dmpyz) oxidará selectivamente un grupo metileno bencílico a un carbonilo: (ArCH 2 R → ArC(O)R).[7] El ácido 2-yodoxibenzoico en DMSO funciona de manera similar. [8]